中枢神经系统孤立性纤维瘤(Central Nervous System Solitary Fibrous Tumor,CNS SFT)是一种罕见的间充质型肿瘤,具有多分化潜能,恶性、侵袭性和高度血管化特征。目前临床诊疗主要面临两个亟待解决的困局:其一,CNS SFT常附着于硬膜,影像学表现类似脑膜瘤,临床上极易误诊;但相比脑膜瘤,其侵袭性更强,即使实现肉眼全切,复发率仍高达57%,且具有远处转移倾向。其二,CNS SFT对化疗不敏感,放疗不能改善总体预后,缺乏标准化的系统治疗方案。寻找CNS SFT分子标志物和开发药物治疗靶点是急需攻克的临床难题。
2025年8月23日,北京脑科学与类脑研究所陈坚团队、北京大学医学院杨恩策团队、首都医科大学天坛医院贾旺团队、三博脑科医院闫长祥团队以及皖南医学院第一附属医院江晓春团队的研究人员合作在Nature Communications上发表了文章Molecular landscape, subtypes, and therapeutic vulnerabilities of central nervous system solitary fibrous tumors。本研究共收集189个SFT样本进行全面的基因组、转录组、单细胞及空间转录组的多组学分析,并建立了13株患者来源的CNS SFT细胞系,进行高通量药物筛选、靶标验证及通路机制研究,为CNS SFT个体化治疗和药物开发提供了重要依据。
全基因组测序结果显示,高达87%的CNS SFT样本携带经典的NAB2-STAT6基因融合。值得关注的是,除了该融合突变,研究还发现多种参与细胞迁移与信号转导的受体酪氨酸激酶(RTK)基因突变频发。进一步的免疫组织化学分析表明,在高级别CNS SFT中,p-ERK与p-S6信号显著增强,提示RTK通路的持续激活可能与肿瘤进展密切相关。
基于对转录组数据的系统性分析,研究团队首次将CNS SFT清晰地划分为四种分子亚型,分别为:“经典型”(Classical)、“神经样型”(Neural-like)、“炎症型”(Inflamed)和“迁移型”(Migratory)。这四类亚型在基因表达谱上展现出显著差异,且与肿瘤的病理级别、增殖活性、坏死程度及免疫微环境特征密切相关。例如,“经典型”表现传统SFT的典型特征,显示出更高的囊性坏死;“神经样型”富含细胞分化与神经递质分泌通路,常见于低级别肿瘤,预后较好;“炎症型”则表现出NF-κB通路高度激活及T细胞浸润,提示其对免疫治疗可能具有更高敏感性;“迁移型”富集细胞骨架重塑相关通路,可能与肿瘤侵袭性增强有关。
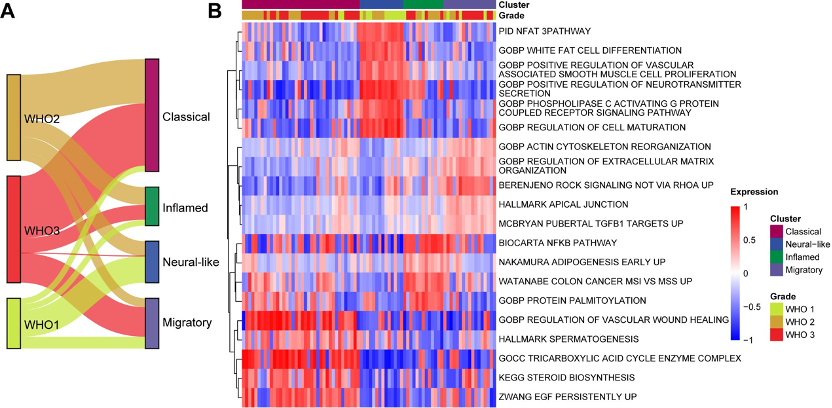
为深入解析CNS SFT肿瘤内部的细胞异质性,研究团队结合单细胞核RNA测序与空间转录组测序技术,在单细胞分辨率上精细描绘了肿瘤的细胞组成与空间格局。分析共鉴定出五种功能状态各异的肿瘤细胞类型,包括:“经典状态”(SFT-Classical)、“炎症状态”(SFT-Inflamed)、“神经样状态”(SFT-Neural-like)、“迁移状态”(SFT-Migratory)及“血管生成状态”(SFT-Angiogenic)。其中,SFT-Classical细胞被认为可能是“前体状态”,在缺氧、炎症等微环境信号诱导下,向其他状态转化,推动肿瘤功能多样化和恶性演进。
空间转录组分析进一步证实了这一演化轨迹,明确展示出不同细胞状态在肿瘤组织内的空间分布规律:如SFT-Neural-like状态主要存在于低级别肿瘤中,SFT-Inflamed状态富集于炎症细胞浸润区域,SFT-Migratory细胞聚集于中度缺氧区,而SFT-Angiogenic状态则限于极端缺氧区。这些发现揭示了肿瘤细胞状态与局部微环境之间复杂的动态互作机制,是推动CNS SFT异质性与进展的关键驱动力。
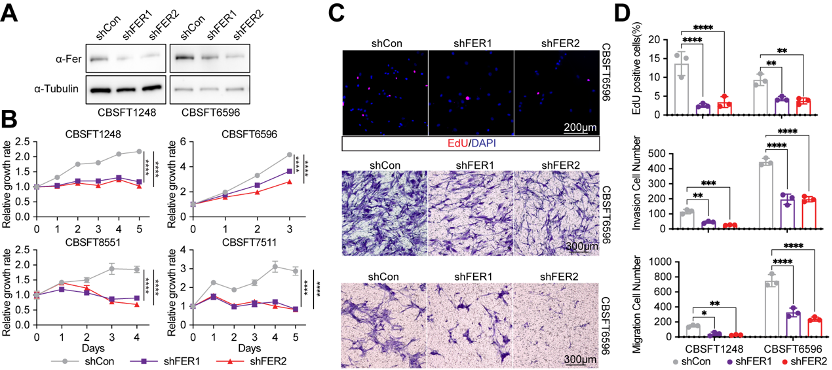
为寻找CNS SFT潜在的治疗药物和靶点,研究团队建立了目前国际上规模最大的CNS SFT原代细胞库,共计13株源自患者的新鲜肿瘤组织的原代细胞系。通过高通量小分子药物筛选体系,系统评估了超过4000种FDA批准及进入临床试验化合物的药效,结果发现:原代CNS SFT细胞对多种受体酪氨酸激酶(RTK)抑制剂表现出显著敏感性,其中包括临床常用的ALK抑制剂Ceritinib和EGFR家族抑制剂Pyrotinib。进一步的药物靶点解析中,研究人员鉴定出一个此前在SFT中未被系统研究的重要分子靶点——FER激酶。两种FER特异性抑制剂E260和DS21360717在多株原代细胞中展现出与Ceritinib、Pyrotinib相当甚至更优的抗增殖效果。功能实验证实,通过药物干预或shRNA沉默FER表达,均可显著抑制CNS SFT细胞的增殖、迁移与侵袭能力。机制研究进一步揭示,FER作为RTK下游多个关键信号通路的整合枢纽,是调控CNS SFT恶性进展的重要驱动因子。这一系列发现不仅为FER激酶的“可成药性”提供了坚实依据,也为临床治疗CNS SFT提供了全新的靶向策略与希望。
本研究是迄今为止针对中枢神经系统孤立性纤维瘤最为系统的多组学研究,全面解析了其驱动突变谱、分子亚型、细胞状态演化及与微环境的动态互作机制。研究首次建立了CNS SFT的分子分型框架,为临床的精准诊断与治疗提供科学依据;同时,首次发现并验证FER激酶为关键治疗靶点,为开发新型靶向药物指明方向。该成果不仅为CNS SFT的机制研究与临床转化奠定坚实基础,也为罕见肿瘤的系统研究树立了新范式。
论文信息
北京脑科学与类脑研究所访问学者赵晨辉博士、北京大学医学院胡雪嫣博士、首都医科大学天坛医院管修东博士、三博脑科医院付晓君博士和北京协和医学院博士研究生王婷婷为本文的共同第一作者。该工作得到国家重点研发计划(#2022YFA1103900)、中国医学科学院医学与健康科技创新工程重大任务专项(#2024-I2M-ZD-012)、中国高校产学研项目(#2023HT007)、安徽省科技创新团队项目(#2022AH010073)、昌平国家实验室和北京脑科学与类脑研究所的资助支持。
